一氧化氮对慢性鼻窦炎鼻息肉粘膜上皮细胞纤毛运动的影响
【摘要】 目的 观察一氧化氮(nitric oxide,NO)对人鼻粘膜纤毛运动的影响。方法 建立慢性鼻窦炎鼻息肉粘膜上皮细胞原代培养模型,用电视显微镜法观察NO前体L-精氨酸对纤毛运动的影响,统计学方法采用配对t检验。结果 L-精氨酸能使纤毛运动频率由加药前的每分钟(400±48)次增加到加药后的每分钟(793±68)次(n=9,P<0.001);其同分异构体D-精氨酸无此作用;一氧化氮合酶(nitric oxide synthase,NOS)抑制剂硝基- L-精氨酸甲酯能明显抑制L-精氨酸的作用。结论 原代培养慢性鼻窦炎鼻息肉粘膜上皮细胞能合成NOS,L-精氨酸在NOS的作用下产生NO,从而加快纤毛细胞的纤毛运动。
Effects of nitric oxide on ciliary beat frequency in the human nasal mucosa
WANG Feng, SU Zhenlun, WANG Li, et al.
(Department of Otorhinolaryngology,General Hospital of PLA, Beijing 100853, China)
【Abstract】 Objective To investigate the effect of nitric oxide on ciliary beat frequency in human nasal mucosa. Method A primary culture model of human nasal mucosa epithelial cells was established and the effect of nitric oxide on ciliary beat frequency was observed by videomicroscopy method. The data were statistically analyzed using t-test. Result L-arginine significantly increased ciliary beat frequency from (400±48) beats/min to (793±68) beats/min (n=9,P<0.001),D-arginine had no similar effect,while NOS blocker L-NAME inhibited the effect of L-arginine. Conclusion Cells cultured by our method could synthesize NOS that made L-arginine produce NO that could increase ciliary beat frequency in the human nasal mucosa.
【Key words】 Nasal mucosa; Nitric oxide; Microscopy, video; Cells culture; Cilia
近年来,许多学者以组化、免疫组化、原位杂交等方法证明,人类及其他动物如鼠、兔、牛呼吸上皮存在一氧化氮合酶(nitric oxide synthase, NOS)。Furukawa等[1]证明人鼻粘膜血管内皮细胞、上皮细胞及粘膜下腺体有很强的Ⅲ型NOS表达,而上皮细胞、浆液腺体、炎性细胞和血管内皮细胞有中等强度的Ⅱ型NOS表达。生理条件下,细胞因子诱导NOS合成内源性一氧化氮(nitric oxide,NO),NO能增强纤毛细胞纤毛运动、刺激粘液分泌;扩张气管、支气管,提高肺顺应性,提高血氧饱和度[1,2]。急性鼻炎、鼻窦炎患者鼻腔中NO浓度降低,抗生素治疗后NO浓度恢复[3];慢性鼻窦炎患者鼻腔NO浓度降低,与之相应,其鼻粘膜纤毛运动频率减慢,甚至个别患者鼻粘膜纤毛变形[4]。NO前体L-精氨酸能诱导NOS合成NO[5]。本研究通过建立人鼻粘膜上皮细胞原代培养模型,用电视显微镜法测量鼻粘膜纤毛运动频率,观察L-精氨酸对鼻粘膜纤毛运动的影响,从而探索治疗慢性鼻炎、鼻窦炎的新途径。
材料和方法
1.鼻粘膜上皮细胞的分离与培养:鼻粘膜来源于行鼻窦炎、鼻息肉手术的21例患者。参照Wu等[6]的方法将术中取下的鼻粘膜放入含0.1%胶原酶的Hanks液中,4℃消化16~18 h或37℃ 消化30 min,以吸管轻轻吹打2~3 min,使上皮片脱落。取细胞悬液,离心,弃上清,加入含15%胎牛血清、氟康唑 1 μg/ml,庆大霉素10 μg/ml的Dulbecco 改良 Eagle 培养基和Ham F12为1∶1的培养基,制成细胞悬液,将其移到35 mm培养皿里,每皿2.0 ml细胞悬液,置入饱和湿度的37℃恒温孵箱中,在95%空气、5% CO2条件下培养。
2.纤毛运动频率的测量:用倒置相差显微镜(西德,Axiovert35)观察,彩色摄像机(日本,松下,WV-3600N)和录像机(JVC,HR-D257MS)摄像、录像。加药前、后视野不变。测量时慢速回放。每个样本测量不同部位的5个细胞,取每个细胞的一束纤毛数其纤毛运动频率,以5个细胞纤毛运动频率的平均值为每个个体的纤毛运动频率。实验在室温下(23℃~25℃)进行。
3.实验设计与统计学分析:将培养细胞随机分为3组,分别加入L-精氨酸、D-精氨酸、硝基- L-精氨酸甲酯,3组中观察患者个体数分别为9、4、8例,以加药前、后作自身对照,观察L-精氨酸(NO前体)对纤毛运动的影响。实验结果以均数±标准差表示,统计学分析用SAS软件,方法用配对t检验,P<0.05具有统计学意义。
结果
1. L-精氨酸(10-2 mol/L)对纤毛运动频率(ciliary beat frequency, CBF)的影响:加药前,CBF为每分钟(400±48)次,加入L-精氨酸后,CBF立即加快,为每分钟(793±68)次(图1,P<0.001)。
2.D-精氨酸(10-2 mol/L)对纤毛运动频率的影响:加药后1~20 min内,纤毛运动频率无明显变化。加药前CBF为每分钟(554±17)次,加药后CBF为每分钟(512±25)次(图1,P>0.05)。
3.硝基- L-精氨酸甲酯(10-5 mol/L)对L-精氨酸(10-2 mol/L)的作用的影响:加硝基- L-精氨酸甲酯1~15 min内,纤毛运动频率无明显变化,加药前CBF为每分钟(442±29)次,加药后CBF为每分钟(443±24)次。再加入L-精氨酸(10-2 mol/L)后,纤毛运动频率稍加快,为每分钟(524±38)次,但变化无显著统计学意义,(图1,P>0.05)。
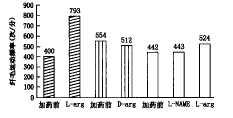
图1 L-精氨酸(L-arg)、D-精氨酸(D-arg)、硝基- L-精氨酸甲酯(L-NAME)对纤毛运动频率的影响
讨论
1998年,Runer等[7]分别以L-精氨酸,D-精氨酸作用于兔上呼吸道粘膜块,发现L-精氨酸能加强粘膜纤毛运动,D-精氨酸无类似作用。NOS 阻滞剂硝基-L-精氨酸甲酯能减弱L-精氨酸的这种作用。说明NO能加快兔上呼吸道粘膜纤毛运动频率。同年,Runer等[8]以硝普钠按临床用量喷雾于8名健康志愿者一侧鼻腔,发现用硝普钠后鼻腔内NO浓度立即升高,鼻粘膜血流增加(67.3±15.5)%,粘液纤毛功能增加(57.2±6.7)%。对侧无这种现象。患者无鼻塞、分泌物增多、恶心、疼痛、面部潮红等现象,表明受试者纤毛运动频率加快非硝普钠的神经反射作用引起。证明在体人鼻粘膜粘液纤毛传送功能由NO介导。
本实验用培养慢性鼻窦炎鼻息肉上皮细胞为实验材料,证明L-精氨酸能明显加快培养细胞的纤毛运动频率,D-精氨酸无类似作用。硝基-L-精氨酸甲酯能明显抑制L-精氨酸的作用。上述结果表明:所培养鼻粘膜上皮细胞能合成NOS,L-精氨酸在NOS的作用下合成NO,从而加快纤毛运动频率。D-精氨酸不产生NO ,故不能加快纤毛运动频率。硝基-L-精氨酸甲酯抑制NOS的活性,因此,明显抑制L-精氨酸对纤毛运动的影响。
已经公认,纤毛运动的能量是由其动力臂ATP酶分解ATP产生的,ATP由细胞表面靠近纤毛基底部的线粒体产生。乙酰胆碱能加快呼吸道纤毛运动频率。1996年,Yang等[9]发现,呼吸道纤毛运动至少有2种调节途径:①β2-肾上腺素能受体-环腺苷酸(cyclic adenosin monophosphate,cAMP)途径;②毒蕈碱受体-前列腺素、NO和环鸟苷酸(cyclic guanosline monophosphate,cGMP)途径。1999年,Runer等[10]发现特普他林、乙酰胆碱、P物质、内皮细胞因子-1诱导由NO介导的纤毛运动频率加快。许多作者[11-13]通过实验证明,肿瘤坏死因子α(tumor necrose factor-α,TNF-α)、白介素-1、白介素-4、γ-干扰素能诱导内源性NO产生,从而加快纤毛运动频率。有作者发现NO能加强缓激肽、ATP诱导的细胞内钙离子浓度([Ca2+]i)增高,从而加强[Ca2+]i调控的上皮功能[14]。综上所述,我们对纤毛运动的生理机制有了如下进一步认识,即各种递质、细胞因子诱导NOS利用L-精氨酸合成NO,NO调节细胞内环鸟苷酸代谢,从而使呼吸道纤毛运动加快和粘液分泌增多。
Kartagener综合征的病理改变特点除了纤毛动力臂缺失引起纤毛功能紊乱以外,还有呼吸道NOS缺失,这些患者呼出气体中NO浓度降低[15]。Baraldi等[3]发现,急性鼻炎、鼻窦炎儿童患者鼻腔中NO体积分数较同龄健康对照组明显降低达(70±8.7)×10-12,用抗生素治疗后NO浓度升高,与健康对照组鼻腔中NO体积分数相近为(245±15)×10-12。Lindberg等[2,4]发现,健康人鼻腔NO体积分数为(233.2±66.8)×10-12,与年龄和体重无关,慢性鼻窦炎患者鼻腔NO浓度降低,鼻粘膜纤毛运动频率明显降低,鼻粘膜纤毛变形。上述资料表明,先天性呼吸道上皮NOS缺乏引起的NO浓度降低、粘液纤毛传送功能障碍会导致严重的呼吸系统疾病;而许多呼吸系统疾病能引起NO浓度降低,纤毛粘液传送功能下降。
我们的离体实验和Runer等[7]的在体实验以及临床资料证明,NO能促进鼻粘膜上皮细胞纤毛运动,对呼吸道具有保护性,是呼吸系统正常生理功能的重要因素,因此,我们设想NO供体硝普钠和NO前体L-精氨酸也许会在治疗慢性鼻窦炎、Kartagener综合征等与NO浓度下降有关的疾病中发挥积极的作用。
参考文献
1,Furukawa K,Harrison DG,Saleh D , et al. Expression of nitric oxide synthase in the human nasal mucosa. Am J Respir Crit Care Med, 1996, 153:847-850.
2,Lindberg S, Cervin A, Runer T. Low levels of nasal nitric oxide correlate to impaired mucociliary function in the upper airways. Acta Otolaryngol,1997,117:728-734.
3,Baraldi E, Azzolin NM, Biban P, et al. Effect of antibiotic therapy on nasal nitric oxide concentration in children with acute sinusitis. Am J Respir Crit Care Med, 1997,155: 1680-1683.
4,Lindberg S, Cervin A, Runer T. Nitric oxide production in the upper airways is decreased in chronic sinusitis. Acta Otolaryngol, 1997,117:113-117.
5,Jorens PG,Vermeire PA,Herman AG. L-arginine dependent nitric oxide synthase:a new metabolic pathway in the lung and airways.Eur Respir J,1993,6:258-266.
6,Wu R, Yankaskas J, Cheng E. Growth and differentiation of human nasal epithelial cells in culture. Am Respir Dis,1985,132: 311-320.
7,Runer T, Cervin A, Lindberg S, et al. Nitric oxide is regulator of mucociliary activity in the upper respiratory tract. Otolaryngol Head Neck Surg, 1998,119:278-287.
8,Runer T, Lindberg S. Effects of nitric oxide on blood flow and mucociliary activity in the human nose. Ann Otol Rhinol Laryngol, 1998,107:40-46.
9,Yang B, Schlosser RJ, McCaffrey TV. Dual signal transduction mechanisms modulate ciliary beat frequency in upper airway epithelium. Am J Physiol,1996,270:L745-751.
10,Runer T, Lindberg S. Ciliostimulatory effects mediated by nitric oxide. Acta Otolaryngol, 1999, 119: 821-825.
11,Robbins RA,Sisson JH,Springall DR,et al. Human lung mononuclear cells induce nitric oxide synthase in murine airway epithelial cells in vitro:role of TNF alpha and IL-1beta. Am J Respir Crit Care Med,1997,155:268-273.
12,Guo FH, Uetani K, Haque SJ, et al. Interferon gamma and interleukin 4 stimulate prolonged expression of inducible nitric oxide synthase in human airway epithelium through synthesis of soluble mediators. J Clin Invest,1997,100: 829-838.
13,Jain B, Rubinstein I, Robbins RA, et al. TNF-alpha and IL-1 beta upregulate nitric oxide-dependent ciliary motility in bovine airway epithelium.Am J Physiol,1995,268:L911-917.
14,Sakai A,Kondo M,Tamaoki J,et al.Nitric oxide modulation of Ca2+ responses in cow tracheal epithelium. Eur J Pharmacol, 1995,291: 375-379.
15,Lundberg JON,Weitzberg E,Nordvall SL,et al.Primarily nasal origin of exhaled nitric oxide and absence in Kartagener′s syndrome. Eur Respir J, 1994, 7: 1501-1504.
- 两性
- 男人
- 女性
- 母婴
|
· 处女座的特点 · 处女座最佳配对星座 · 2010年处女座运势 · 处女座女人的爱情 · 如何追处女座女人 · 处女座女人的特点 · 处女座女人 · 处女座男人喜欢的女人 · 如何对付处女座男人 |
|
· 怎样看待遗精 · 什么是滑精 · 什么是梦遗 · 什么是干燥性闭塞性龟头炎? · 前列腺炎检查 · 包皮手术过后多久可以性生活 · 早泄是不是跟包皮过长有关? · 早泄等于射精过快吗? · 体外射精有什么害处 |
|
· 女性经期切记将绿茶挡在门外 · 生命中的一次婚外恋 · 一个流氓和妓女的故事 · 最唯美的10首中国情诗 · 娇妻玩合租 结果引火烧身 · 男人必须了解女人的一些事 · 当女朋友被领导叫去陪酒 · 易让男人退避三舍的10类女人 · 老男人为什么招小女人的喜欢? |
|
· 春季合理喂养婴儿健康指南 · 如何正确使用空调保证健康 · 让宝宝接受保姆的三大招 · 哪些产妇需做会阴侧切 · 导致分娩时难产4因素 · 看美国准妈人性化孕产经历 · 准妈妈如何预防春季感冒? · 胎盘和脐带的功能与重要性 · 烟、酒和咖啡对胎儿的影响 |






