血小板活化因子拮抗剂对猪急性重症胰腺炎后肺和气管粘膜损伤的影响
Influences of BN50739 on neutrophil elastase and phospholipase A2 in lung and tracheal mucosa of pigs with acute severe pancreatitis
TU Weifeng, LI Jieshou, ZHU Weiming, et al.
(Institute of General Research, Nanjing General Hospital, Nanjing 210002, China)
【Abstract】 Objective To investigate the effects of platelet-activating factor (PAF) and a new potent PAF-receptor antagonist, BN50739, on the activities of neutrophil elastase and phospholipase A2 (PLA2) in lung and tracheal mucosa of pigs with acute severe pancreatitis (ASP) induced by sodium taurocholate.Methods There were twenty eight pigs weighing 16~22 kg, which were divided into five groups. Group Ⅰ (n=5):sham-control; Group Ⅱ (n=6): ASP-control; Group Ⅲ (n=5): DMSO-control; Group Ⅳ (n=6) and Group Ⅴ (n=6): pre-and post-treatment with BN50739. Anesthesized pigs were subjected to ASP induced by injecting 1 ml/kg of combined solution of 5% sodium taurocholate and 8 000~10 000 BAEE units trypsin/ml into pancreas via pancreatic duct. All pigs were sacrificed by injecting 20 ml of 10% KCl intravenously. Specimens of lung and tracheal mucosa were removed, weighed and homogenized in grinding tubes. The homogenate was centrifuged and the supernatants were collected for the assays of NE, PLA2, MPO and PAF. Results The activities of NE, PLA2 and MPO and the levels of PAF in lung and tracheal mucosa increased significantly in ASP pigs. There are significantly positive relationships between PAF and NE, PLA2, MPO or W/D in lung and tracheal mucosa. The PAF levels in lung and tracheal mucosa and the severity of acute lung injury induced by PMN sequestration, NE and activated PLA2 reduced remarkably by the pre-and post-treatment with BN50739. Conclusions PAF plays an important role in acute lung injury in porcine ASP, which may be associated with the increments of PMN sequestration, NE and the highly activated PLA2 in lung and tracheal mucosa. The pre-and post-treatment with BN50739 can effectively reduce the PAF levels in lung and tracheal mucosa and the severity of acute lung injury following ASP via reducing the PMN sequestration and the amount of elastase, and by inhibiting PLA2 activities in lung and tracheal mucosa.
【Key words】 Acute severe pancreatits; Platelet-activating factor; BN50739; Acute lung injury; Elastase
血小板活化因子(PAF)在诸多炎症反应如急性重症胰腺炎(ASP)的病理损伤过程中起着重要作用[1-3],而预防性应用PAF受体拮抗剂如WEB21270、BN5021可以明显减轻胰腺炎性肺损伤[2]。但有关PAF拮抗剂对ASP后肺损伤的保护机制仍不很清楚。BN50739是一种新型PAF特异性受体拮抗剂。有研究显示,BN50739对缺血再灌注后脑损伤[4]、心肌损伤和心律失常[5-8],内毒素介导性肝损伤[9,10]、红细胞膜损伤[11],嗜中性粒细胞(PMN)介导性心肌损伤有明显的保护作用[12,13]。但尚未见有关BN50739对猪ASP后PMN、嗜中性粒细胞弹性蛋白酶(NE)、磷脂酶A2(PLA2)介导性肺损伤保护作用研究的报道。
材料与方法
一、动物分组
选健康长白种猪28只(南京军区动物实验中心提供),体重16~22 kg,雌雄不限,随机分为5组:Ⅰ组(假手术对照组,5只);Ⅱ组(ASP对照组,6只);Ⅲ组[二甲亚砜(DMSO)对照组5只];Ⅳ组(ASP+PAF受体拮抗剂预防组,6只);Ⅴ组(ASP+PAF受体拮抗剂治疗组,6只)。在麻醉状态下,进腹向胰总管内注入1 ml/kg 5%牛磺胆酸钠混合液(内含40~50 IU/ml胰蛋白酶,pH7.6)诱导ASP。以0.9% NaCl磷酸盐缓冲液取代5%牛磺酸钠混合液即为假手术对照组。
二、BN50739配制和使用
PAF特异性受体拮抗剂BN50739由法国Braquet P博士惠赠。Ⅳ组即ASP+PAF受体拮抗剂预防组,按10 mg/kg BN50739于ASP诱导前30 min溶于64%~66% DMSO,配成3.2%~3.3%浓度,缓慢从腔静脉内注入,速度根据血管内平均动脉压(MAP)的变化调节,保持MAP的波动不大于3.75~7.5 mm Hg(1 mm Hg=0.133 kPa)。Ⅴ组即ASP+PAF受体拮抗剂治疗组,于ASP诱导后6 h开始给予BN50739,首次用量为10 mg/kg,以后均为5 mg/kg,q 8 h。以64%~66% DMSO取代BN50739,即为Ⅲ组DMSO对照组。
三、急性重症胰腺炎的诱导和管理
参见以往方法[14]。
四、样本采集和处理
存活的猪在72 h后用10% KCl处死,立即留取胰腺、肺组织,部分用10%福尔马林磷酸缓冲液(pH7.4)固定,常规石蜡切片、HE染色;部分肺组织块先用预冷的生理盐水(0~4 ℃)冲洗,除去血液,滤纸拭干,称重,用1∶9的匀浆介质(0.025 mol/L Tris-HCl缓冲液,内含0.25 mol/L蔗糖,0.0001 mol/L EDTA-Na2,pH7.5)制备组织匀浆,3500 r/min离心15 min (0~4 ℃),上清-20 ℃保存备用,以检测组织PAF(生物活性检测法)[15]、NE[16]、PLA2[17]和髓过氧化物酶(MPO)。气管粘膜的获取:在气管离体后立即用预冷的生理盐水冲洗气管粘膜至无粘液,并轻轻地钝性分离气管粘膜,粘膜匀浆的制备同肺组织。
统计学处理:所列计量资料均采用均数±标准差表示,应用统计软件包STATISCA/W5.0作方差分析、Newman-Keuls′检验和t检验。
结果
一、肺组织中PAF和NE含量及PLA2和MPO活性的变化
Ⅱ、Ⅲ组肺组织中PAF和NE含量及PLA2和MPO活性较正常对照组即Ⅰ组明显升高(P均<0.01),但两组间差异无显著性。预防或治疗性应用BN50739均可非常显著性地减少ASP猪肺组织中的PAF和NE含量及PLA2活性,但仍明显高于正常对照组(P均<0.01)。预防性应用BN50739均非常显著性地减少肺组织中MPO活性,而BN50739治疗组MPO活性无明显变化(表1)。
二、气管粘膜中PAF和NE含量及PLA2活性的变化
Ⅱ、Ⅲ组气管粘膜PAF和NE含量及PLA2活性较正常对照组明显升高(P均<0.01),但两组间差异无显著性。预防或治疗性应用BN50739均可显著地减少ASP猪气管粘膜中的PAF和NE含量及PLA2活性,但仍要明显高于正常对照组(P均<0.01,表2)。
三、组织湿干重比和组织含水量的变化
组织湿干重比(W/D)和组织含水量(TTW)在Ⅲ组的变化与ASP对照组基本一致,两组间差异无显著性。预防或治疗性应用BN50739均可使W/D和TTW明显降低,但仍要显著高于正常对照组(表3)。
表1 实验猪肺组织中PAF、NE、PLA2和
MPO活性的变化(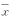 ±s)
±s)
| 组别 | 动物
数 (只) |
PAF
(ng/g) |
NE
(μg/mg) |
PLA2
(μmol· min-1.mg-1) |
MPO
(nmol· min-1.g-1 |
| Ⅰ组 | 5 | 12.6±
1.4 |
28±
3 |
0.33±
0.06 |
0.360±
0.020 |
| Ⅱ组 | 6 | 78.5±
4.2* |
264±
149* |
1.35±
0.03* |
2.070±
0.620* |
| Ⅲ组 | 5 | 82.0±
78.7* |
270±
103*△▲ |
1.49±
0.08* |
2.130±
0.140* |
| Ⅳ组 | 6 | 35.9±
8.2*△▲ |
152±
64*△▲ |
0.83±
0.20*△▲ |
1.050±
0.140*△▲ |
| Ⅴ组 | 6 | 27.7±
9.5*△▲ |
174±
78*△▲ |
0.81±
0.13*△▲ |
2.050±
0.830* |
注:与Ⅰ组比较* P<0.01;与Ⅱ组比较△ P<0.01;与Ⅲ组比较▲ P<0.01
表2 实验猪气管粘膜中PAF、NE和PLA2活性的
变化(x±s)
| 组别 | 动物
数 (只) |
PAF
(ng/g) |
NE
(μg/mg) |
PLA2
(μmol·min-1. mg-1) |
| Ⅰ组 | 5 | 12.6±1.4 | 28± 3 | 0.327±0.063 |
| Ⅱ组 | 6 | 78.5±4.2* | 264±149* | 1.345±0.027* |
| Ⅲ组 | 5 | 82.0±78.7* | 270±103* | 1.494±0.075* |
| Ⅳ组 | 6 | 35.9±8.2*△▲ | 152±64*△▲ | 0.830±0.197*△▲ |
| Ⅴ组 | 6 | 27.7±9.5*△▲ | 174±78*△▲ | 0.810±0.128*△▲ |
注:与Ⅰ组比较* P<0.01;与Ⅱ组比较△ P<0.01;与Ⅲ组比较▲P<0.01
表3 实验猪组织湿干重比和组织含水量的变化(x±s)
| 组别 | 动物
数(只) |
W/D(g/g) | TTW(g/g) | ||
| 肺 | 气管粘膜 | 肺 | 气管粘膜 | ||
| Ⅰ组 | 5 | 4.38±
0.37 |
4.22±
0.32 |
3.39±
0.37 |
3.22±
0.32 |
| Ⅱ组 | 6 | 5.72±
0.69* |
5.71±
0.37* |
4.73±
0.68* |
4.77±
0.37* |
| Ⅲ组 | 5 | 5.83±
0.22* |
5.78±
0.18* |
4.81±
0.22* |
4.70±
0.18* |
| Ⅳ组 | 6 | 5.19±
0.34*△▲ |
5.12±
0.12*△▲ |
4.19±
0.34*△▲ |
4.12±
0.12*△▲ |
| Ⅴ组 | 6 | 5.20±
0.17*△▲ |
5.24±
0.10*△▲ |
4.20±
0.1*△▲ |
4.24±
0.10*△▲ |
注:与Ⅰ组比较* P<0.01;与Ⅱ组比较△P<0.01;与Ⅲ组比较
▲ P<0.01 四、肺组织中PAF、PLA2、NE、MPO和W/D的相关分析
ASP期间肺组织中炎性介质如PLA2、NE、MPO的改变与PAF含量的高低密切相关(P分别<0.01、0.01和0.05);肺组织W/D的变化与组织中PAF含量、PLA2、NE、MPO活性也密切相关(P分别<0.05、0.001、0.001和0.001,表4)。
五、气管粘膜中PAF、PLA2、NE和W/D的相关分析
ASP期间气管粘膜中炎性介质如PLA2、NE的改变与PAF含量的高低密切相关(P均<0.01);气管粘膜W/D的变化与PLA2、NE活性呈显著正相关(P均<0.001),但未发现与PAF存在很好的相关性(表5)。
表4 实验猪肺组织中PAF、PLA2、NE、MPO和W/D间的
相关分析(r值,n=28)
| PAF | PLA2 | NE | MPO | W/D | |
| PAF | 1 | ||||
| PLA2 | 0.5386△ | 1 | |||
| NE | 0.5020△ | 0.6769▲ | 1 | ||
| MPO | 0.4316* | 0.4449▲ | 0.6222▲ | 1 | |
| W/D | 0.4729* | 0.5788▲ | 0.5761▲ | 0.5959▲ | 1 |
注:* P<0.05,△ P<0.01,▲ P<0.001
表5 实验猪气管粘膜中PAF、PLA2、NE和W/D间的
相关分析(r值,n=28)
| PAF | PLA2 | NE | W/D | |
| PAF | 1 | |||
| PLA2 | 0.5625△ | 1 | ||
| NE | 0.5702△ | 0.6980▲ | 1 | |
| W/D | 0.2161 | 0.7088▲ | 0.7684▲ | 1 |
注:* P<0.05,△ P<0.01,▲ P<0.001
六、组织形态学观察
预防或治疗性应用BN50739均可一定程度地减轻ASP所致的肺组织和气管粘膜损伤,肺组织虽有出血、炎性浸润、肺泡隔增厚、肺间质水肿,但均要明显轻于Ⅱ、Ⅲ组。
讨论
一、PAF与PMN和NE
已证实肺组织中巨噬细胞、尘细胞、肺泡上皮细胞、血管内皮细胞均可合成和释放PAF,但在胰腺炎性肺损伤中,何种细胞是合成和释放PAF的主要细胞仍不清楚。Zhou等[2]认为肺血管内皮细胞是合成和释放PAF的主要细胞,胰源性炎性介质释放入血直接损伤肺血管内皮细胞可能是导致PAF在胰腺炎性肺损伤中大量释放的启动因子。本组研究结果显示,预防或治疗性应用BN50739可不仅明显降低ASP后肺组织和气管粘膜中高浓度的PAF水平,而且使肺和气管粘膜组织W/D和TTW改善、组织PMN扣押减少、NE和MPO活性降低,从而减轻ASP后肺损伤。
PAF引起肺组织和气管粘膜损伤的确切机制尚不清楚,可能与下列因素有关:(1) 血管的直接损伤作用:① 致休克作用,已证实注射外源性PAF可直接抑制心肌中促冠状血管收缩引起心肌收缩力降低,心输出量减少,全身低血压,导致肺和气管粘膜低灌注,造成肺和气管粘膜缺血;② 直接作用于肺血管内皮细胞,引起血管通透性增加[18];③ PAF直接引起毛细血管床收缩,尤其是毛细血管后静脉,导致肺毛细血管静水压增高,血管内液体和大分子物质向血管外渗出[19]或右心室负荷过重和前负荷降低,导致心泵衰竭。(2) 激活中性粒细胞[12,13]:本组研究发现,预防或治疗性应用BN50739可明显降低肺和气管粘膜中MPO、NE活性和PMN浸润量。(3) 抑制肺组织气管粘膜抗氧化还原系统。(4) 促进氧自由基释放:可能与PMN激活密切相关。
二、PAF与PLA2
PLA2是前列腺素和PAF合成的重要限速酶,故在各种炎症性疾病的病理生理过程中可能起着关键作用[19]。已证实急性胰腺炎(AP)可引起血浆PLA2的明显升高,尤其当胰腺炎并发出血坏死时,其活性升高最为显著,认为PLA2是介导胰腺炎后胰腺组织和胰腺外脏器如肺损伤的重要炎性介质。而且AP期间PLA2的激活又可导致能合成和释放PAF的细胞释放大量PAF,同时伴有花生四烯酸产物的释放,从而加重组织损伤。Zhou等[2]发现,静脉内给予PLA2可明显增加AP大鼠的肺组织PAF水平,但不影响正常大鼠的肺组织PAF水平,进一步证实PAF在AP性远离脏器如肺损伤中起着重要作用,而PLA2激活可能是导致PAF在肺局部大量蓄积的重要原因。本组实验结果显示,ASP不仅可引起肺组织和气管粘膜中PAF水平显著上升,而且也可明显降低肺组织和气管粘膜中PLA2,且发现肺组织和气管粘膜中PLA2活性变化与PAF水平呈非常显著正相关,提示PAF和PLA2都是胰腺炎性肺损伤中的非常重要的炎性介质。两者之间有着相互放大或相互制约的作用。
参考文献
1.Konturek SJ, Dembinski A, Konturek PJ, et al. Role of platelet-activating factor in pathogenesis of acute pancreatitis in rats. Gut, 1992, 33:1268-1274.
2.Zhou WG, McCollum MO, Levine BA, et al. Role of platelet-activating factor in pancreatitis with a potent lung injury in rats. Am J Pathol, 1992, 140:971-979.
3.Formaela LJ, Wood LM, Whittaker M, et al. Amelioration of experimental acute pancreatitis with a potent platelet-activating factor antagonist. Br J Surg, 1994, 81:1783-1785.
4.王伟,董为伟.血小板活化因子受体拮抗剂BN50739脑保护作用的实验研究.中华老年医学杂志,1998,17:227-231.
5.韩雅玲,陈思聪,郑钦岳,等. 血小板激活因子及其拮抗剂BN50739对大鼠缺血-再灌注心律失常的影响.中华心血管病杂志,1995, 23:144-145.
6.徐荣良. 血小板激活因子受体拮抗剂BN50739对大鼠早期再灌注心律失常的作用.第二军医大学学报,1993,221-224.
7.Sun D, Kintner D, Fitzpatrick JH, et al. The effect of a free radical scavenger and platelet-activating factor antagonist on FFA accumulation in post-ischemic canine brain. Neurochem-Res, 1994, 19:525-528.
8.Chakrabarty S, Fluck DS, Flores NA, et al. Effects of the PAF antagonists BN50726 and BN50739 on arrhythmogenesis and extent of necrosis during myocaridal ischaemia/reperfusion in rabbits. Br J Pharmacol, 1992, 107:705-709.
9.吕礼应,康格非.血小板活化因子受体拮抗剂的抗内毒素肝损伤作用研究.中国病理生理杂志,1997, 13:685-689.
10.张继航,胡友梅.血小板活化因子拮抗剂BN50739对内毒素损伤肝脏的保护作用.第三军医大学学报,1998, 20:224-227.
11.吕礼应,康格非.血小板活化因子受体拮抗剂对内毒素所致红细胞膜损伤的保护作用.重庆医科大学学报,1994, 19:101-104.
12.Siminiak T, O′Gorman DJ, Shahi M, et al. Plasma mediated neutrophil stimulation during coronary angioplasty: autocrine effect of platelet activating factor. Br Heart J, 1995, 74:625-630.
13.Siminiak T, Egdell RM, O′Gorman-DJ, et al. Plasma-mediated neutrophil activation during acute myocardial infarction: role of platelet-activating factor. Clin Sci Colch, 1995, 89:171-176.
14.屠伟峰,黎介寿,朱维铭,等.猪急性重症胰腺炎与肠源性细菌/内毒素易位.中国胃肠外科杂志,1998, 1:22-25.
15.Soerensen J, Kald B, Tagesson C, et al. Platelet-activating factor and phopholipase A2 in patients with septic shock and trauma. Intens Care Med, 1994, 20:555-561.
16.Geiger R. Elastase. In: Bergmeyer J & Gioβ1 M. Methods of enzymatic analysis. Enzymes 3:peptidase, protinase and their inhibitors. Weiheim: Nerlag Chemie, 1984. 170-184.
17.张文辉,李晓军,武建国,等.血清与精液磷脂酶A2的活力测定和初步应用.临床检验杂志,1996, 14:250-252.
18.Seale JP, Noursharh S, Hellewell PG, et al. Mechanism of action of platelet-activating factor in the pulmonary circulation: An investigation using a novel isotopic system in rabbit isolated lung. Br J Pharmacol, 1991, 104:251.
19.Formela LJ, Galloway SW, Kingshnorth AN. Inflammatory mediators in acute pancreatitis. Br J Surg, 1995, 82:6-13.
- 两性
- 男人
- 女性
- 母婴
|
· 处女座的特点 · 处女座最佳配对星座 · 2010年处女座运势 · 处女座女人的爱情 · 如何追处女座女人 · 处女座女人的特点 · 处女座女人 · 处女座男人喜欢的女人 · 如何对付处女座男人 |
|
· 怎样看待遗精 · 什么是滑精 · 什么是梦遗 · 什么是干燥性闭塞性龟头炎? · 前列腺炎检查 · 包皮手术过后多久可以性生活 · 早泄是不是跟包皮过长有关? · 早泄等于射精过快吗? · 体外射精有什么害处 |
|
· 女性经期切记将绿茶挡在门外 · 生命中的一次婚外恋 · 一个流氓和妓女的故事 · 最唯美的10首中国情诗 · 娇妻玩合租 结果引火烧身 · 男人必须了解女人的一些事 · 当女朋友被领导叫去陪酒 · 易让男人退避三舍的10类女人 · 老男人为什么招小女人的喜欢? |
|
· 春季合理喂养婴儿健康指南 · 如何正确使用空调保证健康 · 让宝宝接受保姆的三大招 · 哪些产妇需做会阴侧切 · 导致分娩时难产4因素 · 看美国准妈人性化孕产经历 · 准妈妈如何预防春季感冒? · 胎盘和脐带的功能与重要性 · 烟、酒和咖啡对胎儿的影响 |






